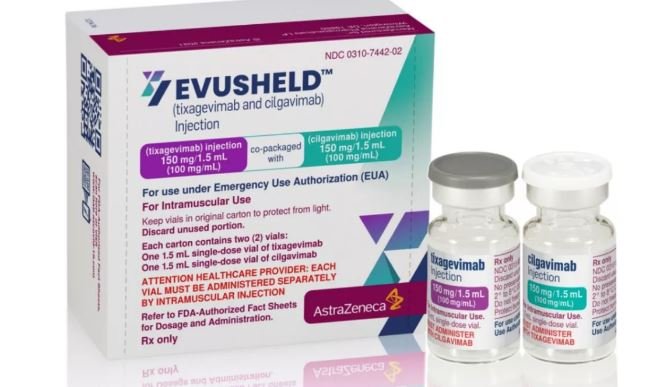
A Agência Nacional de Vigilância Sanitária (Anvisa) suspendeu nesta terça-feira, 7, a autorização de uso emergencial do medicamento Evusheld, da AstraZeneca, indicado para casos leves e moderados de covid-19 em pacientes com alto risco de progressão e agravamento da doença e também de uso na profilaxia pré-exposição.
Com autorização emergencial concedida em fevereiro de 2022, o medicamento não tem se mostrado eficaz contra as variantes predominantes no Brasil, a Ômicron e suas subvariantes. “De acordo com os dados apresentados pela empresa, o Evusheld demonstrou queda significativa na atividade contra as variantes de preocupação do novo coronavírus em circulação no país.”
A suspensão é temporária, “até que sejam apresentados dados que comprovem a sua eficácia contra as variantes do Sars-CoV-2 em circulação no país”. De acordo com o voto da conselheira Meiruze de Sousa Freitas, aprovado por unanimidade, a AstraZeneca deverá comunicar os “profissionais de saúde quanto à ineficácia do medicamento contra as variantes em circulação”.
A relatora afirma que a droga também foi desautorizada nos Estados Unidos, em 26 de janeiro. A Food and Drug Administration (FDA) também considerou o produto ineficaz contras novas variantes e proibiu o uso, para evitar “a exposição dos pacientes a possíveis efeitos colaterais do Evusheld, como reações alérgicas, que podem ser potencialmente graves, em um momento em que menos de 10% das variantes circulantes nos EUA que causam infecção são suscetíveis ao produto”. A agência de saúde europeia (EMA) também emitiu alerta sobre a ineficácia do medicamento da farmacêutica anglo-sueca AstraZeneca.
Revista Oeste